02
“指望不上”的国产新冠特效药?
另一获批特效药阿兹夫定也遭遇了市场的发问。
今年7月25日,国家药监局官方附条件批准阿兹夫定片增加治疗新冠病毒肺炎适应症注册申请。同时,国家药监局要求上市许可持有人继续开展相关研究工作,限期完成附条件的要求,及时提交后续研究结果。
但截至目前,真实生物在阿兹夫定附条件获批上市后,并未有关于阿兹夫定更多更详细的信息披露。
阿兹夫定上一次较为详细的试验数据披露,还要追溯到今年7月。据真实生物微信公众号,其Ⅲ期注册临床试验是采用多中心、随机、双盲、安慰剂对照的临床试验设计,临床试验结果显示,阿兹夫定具有抑制新冠病毒的活性,病毒清除时间为5天左右。
在显著改善临床症状方面,阿兹夫定片可以显著缩短中度的新型冠状病毒感染肺炎患者症状改善时间,提高临床症状改善的患者比例,达到临床优效结果。首次给药后第7天临床症状改善的受试者比例阿兹夫定组40.43%,安慰剂组10.87%(P值<�;0.001),受试者临床症状改善的中位时间阿兹夫定组与安慰剂组有极显著统计学差异(P值<�;0.001)。
此外,阿兹夫定的新冠适应症Ⅲ期临床试验设计了1个主要终点以及17个次要终点。截至目前,真实生物仅披露了三个重点研究情况。
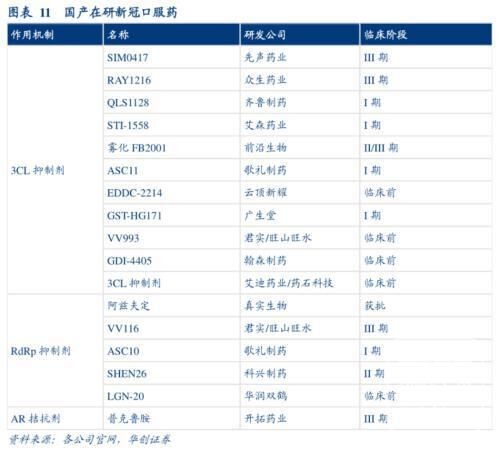
目前,还有5款国产新冠药物处于NDA或临床关键三期的阶段。
君实生物的VV116已于国内完成一项头对头Paxlovid的III期研究,正处于多项国际多中心的三期临床研究阶段,由于君实生物选择常规NDA方式报审而不是EUA,获批消息迟迟未见。
先声药业的SIM0417是最先进入临床的3CL蛋白抑制剂,已完成大部分入组,正在开展三期临床研究中正在开发治疗和预防新冠适应证,进展顺利。
众生药业的RAY1216靶向抑制3CL蛋白酶,11月14日已完成三期首例受试者入组。
前沿生物用于治疗新冠住院患者的注射用FB2001,正在推进国际多中心、随机、双盲、安慰剂对照二期/三期临床试验,目前受试者已入组并给药。
早在今年2月份,开拓药业公布了其普克鲁胺治疗轻重症新冠患者的全球多中心三期临床试验完成中国首例受试者入组及给药。截至目前,开拓药业尚未披露该临床试验最新进展情况。
相比新冠疫苗的批量获批,国产新冠特效药们似乎集体被“困在了时间里”。
|
 本贴仅代表作者观点,与麻辣社区立场无关。
本贴仅代表作者观点,与麻辣社区立场无关。 本贴仅代表作者观点,与麻辣社区立场无关。 麻辣社区平台所有图文、视频,未经授权禁止转载。
本贴仅代表作者观点,与麻辣社区立场无关。 麻辣社区平台所有图文、视频,未经授权禁止转载。